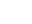医药包装相容性实验流程
医药包装材料相容性研究的内容主要包括三个方面:提取试验、相互作用研究(包括迁移试验和吸附试验)和安全性研究。评估根据包装材料、制剂、生产工艺等要素定制包材相容性研究方案。
提取试验充分考虑药品在生产、贮存、运输及使用过程中可能面临的极端条件进行设计并实施;可提取物检测方法学研究:检测限、定量限、线性、精密度、稳定性;方法开发与验证根据EP、USP和中国药典等指导标准进行。
根据药品的处方和可提取物,选择迁移方法。迁移试验(稳定性留样考察)加速、长期稳定性样品测试,根据CFDA药品研发实验记录规定规范原始数据管理;迁移物检测方法学研究:回收率试验符合要求;其它方法学研究同可提取物。
吸附实验吸附研究主要以药品稳定性研究为主,考察样品储存中主要含量是否改变,同时考察是否由药品包装引起。
安全性评估依据FDA、CFDA、ICH、欧洲药品局(EMA)、致癌性数据库(CPDB)、美国毒物和疾病管理中心(ATSDR)数据库、美国环境保护署(EPA)数据库等标准对迁移物/浸出物进行安全性评估。

提取试验充分考虑药品在生产、贮存、运输及使用过程中可能面临的极端条件进行设计并实施;可提取物检测方法学研究:检测限、定量限、线性、精密度、稳定性;方法开发与验证根据EP、USP和中国药典等指导标准进行。
根据药品的处方和可提取物,选择迁移方法。迁移试验(稳定性留样考察)加速、长期稳定性样品测试,根据CFDA药品研发实验记录规定规范原始数据管理;迁移物检测方法学研究:回收率试验符合要求;其它方法学研究同可提取物。
吸附实验吸附研究主要以药品稳定性研究为主,考察样品储存中主要含量是否改变,同时考察是否由药品包装引起。
安全性评估依据FDA、CFDA、ICH、欧洲药品局(EMA)、致癌性数据库(CPDB)、美国毒物和疾病管理中心(ATSDR)数据库、美国环境保护署(EPA)数据库等标准对迁移物/浸出物进行安全性评估。
药物研发过程中进行医药包装包材相容性试验可指导产品选择合适的包装材料,本文以化学药品采用塑料包装材料相容性研究为例进行说明(《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》)。

誉澳明洁 2014(C)版权所有
技术支持:中科四方